Frühstadien des weißen Hautkrebs rechtzeitig erkennen
Aktinische Keratosen: ein Frühstadium des Plattenepithelkarzinoms
Ein Beitrag von Frau Dr. rer. nat. Larissa Tetsch
Durch Sonnenlicht ausgelöste Veränderungen im Erbgut von hornbildenden Zellen sorgen für deren vermehrtes Wachstum in der Oberhaut. Die dadurch entstehenden Bereiche mit gestörter Gewebestruktur bezeichnet man als aktinische Keratosen. Da sie eine Vorstufe des bösartigen Plattenepithelkarzinoms sind, sollten aktinische Keratosen auch behandelt werden, wenn sie keine Beschwerden verursachen.
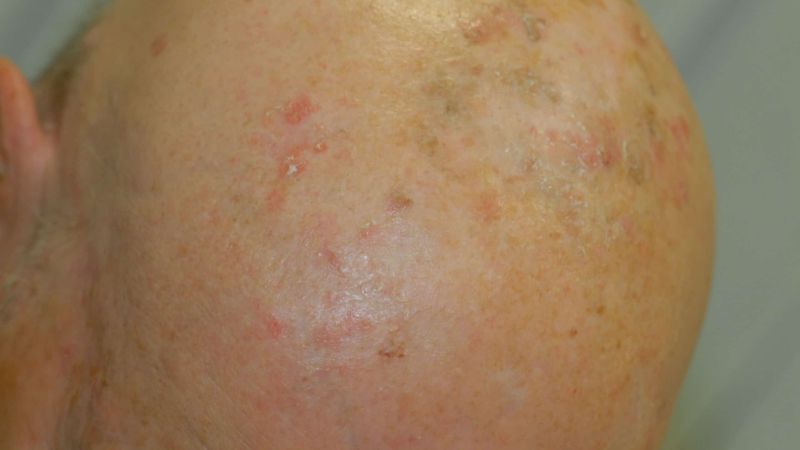
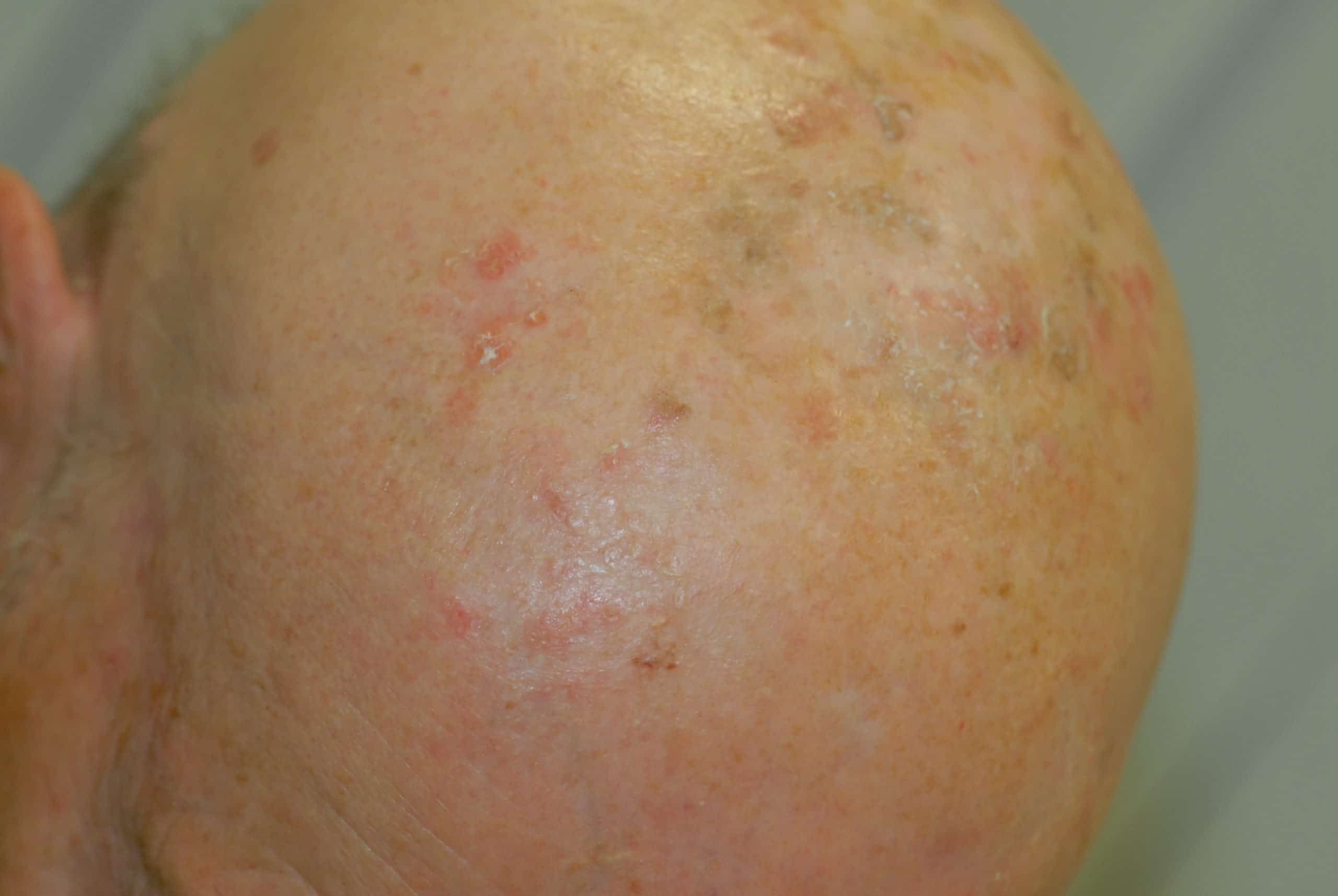
Der Begriff aktinische Keratose stammt aus dem Griechischen („aktis“ = Strahl, „keras“ = Horn) und beschreibt eine durch Sonneneinstrahlung ausgelöste Schädigung der Oberhaut. Aktinische Keratosen verursachen in der Regel keine Beschwerden, entwickeln sich aber mit einem Risiko von 6-10% innerhalb von zehn Jahren zu einem Plattenepithel karzinom, das die zweithäufigste bösartige Hautkrebs darstellt. Ein Plattenepithel karzinom entsteht, wenn sich die Veränderung von der Oberhaut (Epidermis) in die darunter liegende Lederhaut (Dermis) ausbreitet. Aktinische Keratosen sind somit eine Vorstufe (Präkanzerose) von Hautkrebs und können als eine Art Übergangsform zwischen normaler Haut und dem Platten epithel karzinom gesehen werden.
Aktinische Keratosen entstehen bevorzugt auf Hautbereichen, die dem direkten Sonnenlicht ausgesetzt sind: den „Sonnenterassen der Haut“, wie unbehaarte Kopfhaut, Stirn, Nasenrücken, Ohrmuscheln, Wangen, Unterarmen und Handrücken. Hellhäutige Menschen mit blauen Augen sind am stärksten betroffen, da ihre Haut weniger Pigmente produziert, die vor dem Sonnenlicht schützen. So haben alleine Menschen mit dunklen Augen ein 40% geringeres Risiko aktinische Keratosen zu entwickeln. Auch mit zunehmendem Alter steigt das Risiko, da die gesamte, während der Lebenszeit aufgenommene ultraviolette (UV) Strahlung maßgeblich ist. So bilden in Europa 20% der über 60-Jährigen und 52% der über 70-Jährigen aktinische Keratosen aus. Damit ist diese ein häufiges dermatologisches Krankheitsbild, das aufgrund der gestiegenen Lebenserwartung weiter zunehmen wird. Alleine in Deutschland befinden sich zurzeit rund 1,7 Millionen Menschen mit einer aktinischen Keratose in Behandlung, und es ist davon auszugehen, dass deutlich mehr Menschen betroffen sind.
Da Sonneneinstrahlung den Hauptrisikofaktor darstellt, ist die persönliche Lebensführung entscheidend für das Risiko aktinische Keratosen zu entwickeln. So sind vorrangig Menschen betroffen, die sich viel im Freien aufhalten, weshalb für manche Berufsgruppen (beispiels weise im Baugewerbe, in der Landwirtschaft, aber auch für Bademeister und Skilehrer) akti nische Keratosen inzwischen als Berufskrankheit anerkannt sind. Auch Grunderkrankungen wie Xeroderma pigentosum bei der ein Mechanismus für die Reparatur des Erbguts defekt ist, der Kontakt mit Arsen und verschiedenen Chemikalien, Röntgenstrahlen oder radioaktiven Isotopen sowie eine Photochemotherapie zur Behandlung von Schuppenflechte (Psoriasis), Weißfleckenkrankheit (Vitiligo) und Neurodermitis, können die Entstehung aktinischer Keratosen begünstigen.
UV-Licht verändert das Erbgut
Sonnenlicht enthält energiereiche UV-Strahlung, die Veränderungen am Erbgut der Zellen in der Oberhaut auslöst. Betroffen sind vor allem die Keratinozyten, Horn bildende Zellen, die den Hauptbestandteil der Oberhaut ausmachen. Für die Veränderungen am Erbgut ist vor allem die UVB-Strahlung verantwortlich.
Die DNA, Träger der Erbinformation, besteht aus einer Abfolge von Bausteinen, die jeweils eine von vier unterschiedlichen Basen enthalten, deren Reihenfolge die Erbinformationen darstellt. Die Basen kann man sich als Buchstaben vorstellen, die von der Zelle gelesen und in ein funktionstragendes Eiweiß (Protein) übersetzt werden. Die DNA liegt in der Zelle als Doppelstrang vor und wird vor jeder Zellteilung verdoppelt, sodass jede Tochterzelle eine Kopie erhält. Bei der Verdopplung trennen sich die beiden Stränge des Doppelstrangs und jeder Einzelstrang dient als Vorlage, die wieder zu einem Doppelstrang ergänzt wird. Die UV-Strahlung führt nun Änderungen an den Basen der DNA herbei, meist die Verknüpfung zweier nebeneinander liegender Basen. Dies hat zur Folge, dass die Basenabfolge an dieser Stelle nicht mehr richtig gelesen werden kann. Wenn nun die DNA vor der nächsten Zellteilung verdoppelt werden muss, setzt die Zelle gegenüber der veränderten Stelle ein falsches Gegenstück ein. Die Basenabfolge ist damit verändert, und diese Veränderung wird bei allen folgenden Zellteilungen beibehalten.
Diese als Mutation bezeichneten Veränderungen am Erbgut sind nicht an allen Stellen des Genoms gleichermaßen ein Problem. Entstehen sie jedoch in der Bauanleitung eines Eiweißes, so kann es sein, dass dieses seine Funktionsfähigkeit verliert. Bei der Entstehung von Krebs sind häufig Eiweiße betroffen, die an der Regulation von Zellteilungsprozessen beteiligt sind. In der Regel ist dann in diesen Zellen die strikte Kontrolle der Zellteilung aufgehoben, sodass sich die Zellen verstärkt und unkontrolliert teilen. Genau dies geschieht auch bei der Entstehung der aktinischen Keratose. Hier sind es die Horn bildenden Zellen der Oberhaut, die sich vermehrt teilen und dadurch die Gewebestruktur durcheinander bringen.
Typisch für die Entstehung von Krebs ist auch, dass mehrere Mutationen auftreten müssen, da die Zelle einzelne Funktionsausfälle kompensieren kann. Die Entstehung einer aktinischen Keratose und der weitere Übergang zum Plattenepithelkarzinom ist folglich ein mehrstufiger Prozess: Als erstes tritt eine Mutation im Tumorsuppressorgen p53 auf, die bei über 90% der Menschen mit Plattenepithelkarzinom nachweisbar ist. Das dazugehörige Protein p53 wird als Tumorsuppressor bezeichnet, weil es in gesunden Zellen der Entstehung von Tumoren entgegen wirkt.
Abb. 1: Wirkungsweise des Tumorsuppressors p53. p53 ist ein Protein, das Schäden im Erbgut erkennt und daraufhin die Zellteilung anhält. So hat die Zelle Zeit, das Erbgut zu reparieren, damit keine Fehler an die nächste Zellgeneration weitergegeben werden. Ist eine Reparatur nicht möglich, leitet p53 den kontrollierten Zelltod ein. Es wird also eine einzelne Zelle geopfert, um die Entstehung von Krebs zu verhindern. Ist p53 defekt, so teilen sich betroffene Zellen unkontrolliert und häufen dabei weitere Erbgutveränderungen an.
Es reguliert die Zellteilung und unterbindet diese, wenn es Schäden im Erbgut entdeckt. So hat die Zelle Zeit, diese Schäden zu beheben, bevor das Erbgut verdoppelt wird. Falls die Reparatur nicht möglich ist, kann p53 der betroffenen Zelle das Signal geben, den kontrollierten Zelltod (Apoptose) einzuleiten. Die Zelle opfert sich sozusagen, um ihre Erbgutschäden nicht an die nächste Generation weiter zugeben. Fehlt p53, so häufen sich folglich schnell weitere Mutationen an, da betroffene Zellen nicht mehr sterben, sondern sich weiter vermehren. Als nächstes wird häufig das Protoonkogen Ras aktiviert. Ein Protoonkogen enthält den Bauplan für ein Protein mit normaler zellulärer Funktion, wird aber durch eine Mutation in ein Onkogen umgewandelt, das dann die Entstehung von Krebs fördert. Ras ist Bestandteil eines Signalwegs, der die Zellteilung anregt, und nur dann beschritten wird, wenn sich die Zelle teilen soll. Ist Ras nun aufgrund einer Mutation dauerhaft aktiv, kommt es zu vermehrter Teilung der veränderten Zellen. Da vor jeder Teilung das Erbgut verdoppelt wird und dies der Zeitpunkt ist, bei dem sich Erbgutveränderungen ereignen oder – nach einer Schädigung durch Einflüsse von außen – auswirken, erhöht sich bei ungehemmter Vermehrung auch die Mutationsrate. In dieser Phase können sogar ganze Teile von Chromosomen, in denen das Erbgut organisiert ist, verloren gehen. Zwar besitzt jede Zelle jedes Chromosom und damit auch jedes Gen zweifach, aber bereits der Verlust einer Genkopie kann weitreichende Folgen haben, weil dann unter Umständen weniger von einem bestimmten Eiweiß gebildet wird. Geht beispielsweise eine der beiden Genkopien von p16, einem weiteren Regulator der Zellteilung, verloren, so ist dies ein entscheidender Schritt in Richtung Plattenepithelkarzinom.
Spielen Papillomaviren eine Rolle?
Noch ist unklar, ob es einen Zusammenhang zwischen aktinischen Keratosen und einer Infek tion mit humanen Papillomaviren gibt. Diese Viren spielen eine Rolle bei der Entstehung von Gebärmutterhalskrebs und bilden zwei Proteine, die den kontrollierten Zelltod infizierter Zellen unterdrücken. Eines der beiden Proteine hemmt die Bildung eines zellulären Proteins, das den kontrollierten Zelltod begünstigt und das normalerweise in Horn bildenden Zellen hergestellt wird, wenn diese UV-Licht ausgesetzt sind.
Abb. 2: Mehrstufiger Prozess der Krebsentstehung. Am Beginn steht meistens eine Mutation in der genetischen Information für den Tumorsuppressor p53. Fehlt dieser, so häufen sich weitere Mutationen an, die Protoonkogene wie Ras aktivieren. Die höhere Aktivität von Ras führt zu einer vermehrten Zellteilung und zur Ansammlung weiterer Erbgutschäden. So gibt es einen graduellen Übergang von gesunder Haut über die Krebsvorstufe aktinische Keratose bis zum Plattenepithelkarzinom.
Die vorgestellten Prozesse führen alle zu vermehrtem Zellwachstum der Horn bildenden Zellen und damit einhergehend zu einer Störung der Verhornung und der Gewebestruktur der Oberhaut. Da durch die ausufernden Zellteilungsprozesse das Risiko für eine weitere Ansammlung von Mutationen hoch ist, sollten aktinische Keratosen immer behandelt werden, auch wenn sie keine Beschwerden verursachen.
- T. Strunk, R.-M. Szeimies, 2014, Hautarzt 65: 241-254
- M. Majores, E. Bierhoff, 2015, Pathologe 36: 16-29
- A. Dodds et al., 2014, Dermatol. Ther. 4: 11-31